Využití biosenzorů pro rychlou on-line identifikaci mikrobiální kontaminace vod
Vlivem různých faktorů, např. selháním procesu úpravy, lidského faktoru, havárií v distribuční síti apod., může dojít k mikrobiální kontaminaci pitné vody. Pokud k takovéto události dojde, je nezbytná včasná identifikace znečištění, aby mohl být zvolen vhodný postup dekontaminace.
V současné době jsou standardně používány kultivační techniky založené na detekci indikátorových organismů fekálního znečištění a stanovení celkového počtu mikroorganismů. Tyto metody jsou však limitovány pouze na kultivovatelné organismy, kterých je v prostředí pouze nízké procento, a jsou celkem časově náročné. Z tohoto důvodu se výzkumníci již desítky let snaží najít alternativní metody, které by v určitých situacích zastoupily metody kultivační. V rámci projektu FV10312 Biosenzory pro detekci bakteriální kontaminace pitné vody byla již řada senzorových molekul syntetizována a otestována jejich specificita k buněčnému povrchu bakterií Escherichia coli.
1. Mikrobiální kvalita pitné vody
Směrnice 98/83/ES, která je základem české legislativy v oblasti hygieny pitné vody, nastavuje pouze minimální požadavky na kvalitu vody. Vzhledem k významu biologických ukazatelů pro pitnou vodu s ohledem na posouzení rizik a monitorovacího programu je důležitá interpretace výsledků mikrobiologických rozborů. Mikrobiologická kvalita pitné vody je dána vyhláškou č. 252/2004 Sb. (v platném znění) a limity sledovaných ukazatelů zajišťují její zdravotní nezávadnost pro spotřebitele. V důsledku doby zdržení vody v distribuční síti může dojít vlivem různých faktorů, např. selhání procesu úpravy, lidského faktoru, havárie v distribuční síti apod., k mikrobiální kontaminaci. Je zcela namístě vědět, co který z daných ukazatelů kvality vody indikuje a tím pádem i správně a včasně reagovat na nastalou situaci při zjištění přítomnosti indikátorového organismu či patogenu v systému zásobování pitnou vodou do spotřebiště.
Nález koliformních bakterií může v mnoha případech znamenat pochybení v integritě systému zásobování pitnou vodou. Koliformní bakterie byly dříve považovány za hlavní indikátor fekálního znečištění, ale v současnosti jsou využívány ve smyslu operačního monitoringu. Většinou poukazují na přítomnost biofilmů a živin podporujících růst dalších mikroorganismů, projev hydraulických rázů a uvolňování biofilmů po síti, dále pak na případný vliv sekundární kontaminace a nepochybně i technologické závady, jako je například nedostatečná koncentrace dezinfekčního prostředku nebo dlouhá doba zdržení vody v distribuční síti. Zástupcem termotolerantních koliformních bakterií je fakultativně anaerobní a nesporulující E. coli, produkující indol z tryptofanu při teplotě 44 °C během 24 h kultivace. Termotolerantní koliformní bakterie Escherichia coli indikuje v pitné vodě jednoznačné a závažné fekální znečištění, a proto lze tuto bakterii označit jako indikátorový organismus fekální kontaminace a nebezpečí. Při jejím nálezu je zapotřebí okamžitě zjistit zdroj kontaminace. Navíc E. coli indikuje případný výskyt dalších střevních patogenů, kterými jsou salmonely, shigely anebo kampylobaktery. Rizikovým faktorem při mikrobiální kontaminaci pitné vody je přítomnost patogenních mikroorganismů, tj. organismů, které mohou způsobit onemocnění. Pokud k takovéto události dojde, je nezbytná včasná identifikace znečištění, aby mohl být zvolen vhodný postup dekontaminace. Uvedená problematika nabývá zcela zásadně na významu s vyskytujícími se a medializovanými epidemiemi z pitné vody, řešenými v průběhu několika let (Praha Dejvice – srpen 2014, Praha Újezd nad Lesy – září 2014, Praha Dejvice – květen 2015, Trnová – 2014 až 2015, Okrouhlá – srpen 2015, Nový Bor – srpen 2015, Prachatice – říjen 2015 apod.) [1].
A k tomu samozřejmě přistupuje povinnost výrobcům a dodavatelům pitné vody a provozovatelům veřejných vodovodů dle zákona č. 258/2000 Sb. (v platném znění) zpracovat posouzení rizik a tato následně promítnout do provozního řádu a monitorovacího programu. V souvislosti s revizí zákona č. 258/2000 Sb. a jeho prováděcí vyhlášky č. 252/2004 Sb. se pozornost provozovatelů distribučních sítí kritičtěji zaměřuje na rizikové body, které byly opomíjeny. Na místě je nutné konstatovat jednu zcela zásadní skutečnost a tou je, že rychlý a varovný systém, který by byl cíleně zaměřený na hygienickou závadnost pitné vody, bohužel naše vodárenství postrádá. Reakcí na zmíněné havárie a případy epidemií z pitné vody byla spolupráce laboratoře VŠCHT ÚTVP Praha s laboratoří PVK, a.s. v roce 2016 [2, 3].
Výsledky z této spolupráce se staly jedním z cílů směrovaných na vývoj citlivého biosenzoru pro monitorování mikrobiální kontaminace pitné vody v reálném čase v systému on-line [4].
2. Možnosti detekce bakteriální kontaminace
Pro detekci indikátorových organismů, konkrétně pro stanovení E. coli a koliformních bakterií, v pitných vodách je používáno více metod. Tradiční metody detekce zahrnují membránovou filtraci s následnou kultivací na různých specifických médiích s různými podmínkami kultivace a navazujícími konfirmačními testy. Postup stanovení koliformních bakterií a E. coli se řídí požadavky normy ČSN EN ISO 9308-1 Kvalita vod – Stanovení Escherichia coli a koliformních bakterií – Část 1: Metoda membránových filtrů pro vody s nízkým obsahem doprovodné mikroflóry. Metoda specifikuje postup stanovení koliformních bakterií a E. coli ve vodě, nicméně díky nízké selektivitě kultivačního média může růst doprovodné mikroflóry rušit spolehlivé stanovení indikátorových organismů, např. v povrchových vodách anebo vodách z mělkých studní. Ke stanovení se používá chromogenní substrát, Chromogen Coliform Agar (CCA), na kterém současně rostou koliformní bakterie (produkují enzym β-D-galaktosidázu) a Escherichia coli (produkuje enzym β-D-galaktosidázu a β-D-glukuronidázu). Některé kmeny E. coli, které jsou β-D-glukuronidáza negativní, např. Escherichia coli O157, nejsou detekovány jako E. coli, ale protože jsou β-D-galaktosidáza pozitivní, projevují se jako koliformní bakterie (jsou zahnuty do sumy).
Postup stanovení koliformních bakterií se řídí požadavky normy ČSN 75 7837 Jakost vod – Stanovení koliformních bakterií v nedesinfikovaných vodách. Tato metoda platí pro stanovení koliformních bakterií v povrchových, podzemních, odpadních vodách, apod. Lze ji použít i pro pitné vody, kde je nadměrný růst doprovodné mikroflóry. Není vhodná pro vzorky s vysokým obsahem nerozpuštěných látek, které ruší membránovou filtraci nebo kde vysoký počet jiných organismů omezuje růst stanovovaných bakterií.
Metoda uvedená v ČSN 75 7835 Jakost vod – Stanovení termotolerantních koliformních bakterií a Escherichia coli se používá pro stanovení termotolerantních koliformních bakterií v surových povrchových a podzemních vodách a pro stanovení Escherichia coli v nedezinfikovaných pitných vodách a v surových vodách. Není vhodná pro vzorky s vysokým obsahem nerozpuštěných látek nebo s vysokým počtem jiných organismů inhibujících růst stanovovaných bakterií. Současné stanovení koliformních bakterií a Escherichia coli nabízí rovněž metody, které nepatří mezi typické kultivační metody a jsou založené na principu nejvíce pravděpodobného počtu. Validovaná metoda určená pro pitné vody je specifikována normou ČSN EN ISO 9308-2 Kvalita vod – Stanovení Escherichia coli a koliformních bakterií – Část 2: Metoda nejpravděpodobnějšího počtu (IDEEX stanovení metodou definovaného substrátu, kdy je možné výsledek získat již po 18 h). Pro doplnění přehledu stanovení indikátorů fekálního znečištění je možné pro povrchové vody (přírodní koupaliště) a odpadní vody využití metody podle normy ČSN EN ISO 9308-3, která je založena na detekci E. coli v tekutém prostředí selektivně diagnostického média na základě aktivity enzymu ß-D-glukuronidázy metodou nejpravděpodobnějšího počtu (MPN) [5].
Všechny uvedené metody jsou limitovány dobou inkubace, nedostatkem specifičnosti a navíc se obtížně detekují pomalu rostoucí nebo nekultivovatelné mikroorganismy. Výsledky získané těmito metodami se pohybují v rozmezí 1 až 2 dnů.
Z hlediska rychlé identifikace mikrobiální kontaminace a hygienické závadnosti pitné vody je zásadní právě výše zmiňovaná a ve vodárenské praxi dost diskutovaná doba kultivace indikátorového organismu. Namísto klasických kultivačních metod se pro potřeby detekce indikátorových organismů uplatňují i jiné zástupné, popřípadě alternativní metody. Bohužel ne vždy, i když mají dobrou reklamu výrobcem a distributorem, poskytují opravdu data, která lze vztáhnout k reálným podmínkám na distribuční síti.
Naše pracoviště VŠCHT Praha se ve spolupráci s laboratořemi PVK, a.s. zabývalo testování vybraných alternativních metod pro případnou rychlou identifikaci mikrobiální závadnosti pitné vody [2, 3].
Mikrobiální kontaminaci pitné vody lze v současné mikrobiologické praxi monitorovat kromě klasických kultivačních metod i metodami alternativními. Příkladem některých alternativních metod, které se využívají v praxi na různých úrovních, jsou metody zaměřené na biochemickou aktivitu (metoda ATP, H2S strip test), mikroskopické metody využívající fluorescenčního značení (DAPI, FISH) anebo fluorochromy atakující struktury vitálních i mrtvých buněk bakterií (LIVE/DEADTM), dále metody molekulární biologie založené na bázi PCR (polymerázová řetězcová reakce).
Pro měření úrovně ATP (adenosintrifosfát) lze použít například přístroj lumitester PD-10 (Kikkoman Corp.) a stěrky LuciPacW. U ATP je zaznamenávána jeho rychlá přeměna, v systému je poměrně nestabilní. Proto je důležité při odběru vzorku a vlastním měření dodržovat konstantní podmínky, např. teplotu, expozici světlu a hodnotu pH (7–8,5), alespoň 20 min ponechat stěrky temperovat při laboratorní teplotě. Průběh reakce je velmi rychlý, již po 10 sekundách je možné znát výsledek úrovně kontaminace v jednotkách RLU (relativní luminometrické jednotky). U tohoto typu přístroje, lumitester PD-10 a používaných stěrek je nutné zmínit, že původně nejsou vyvinuty pro systém kontroly kvality vody, ale pro hodnocení povrchů v potravinářských zařízeních. Tudíž jakoukoliv případnou kontaminaci v řádech 102 anebo 103 KTJ přítomnou ve vodě, není přístroj schopný ze stěrky adekvátně analyzovat a vyhodnotit, např. vychází falešně negativní signál ve smyslu reálně se vyskytující kontaminace (11 až 15 RLU). Proto je nutné hodnocený vzorek upravit tak, aby bylo možné metodou se swab stěrkami použít. Osvědčil se způsob jednorázové filtrace vzorku vody přes membránové filtry, sterilní millipore 0,22 µm, čímž se zajistí záchyt i případných sporulujících organismů. Navlhčenou stěrkou LuciPacW se pak kvantitativně setře veškerá ulpělá biomasu z povrchu filtru a zjistí se hodnota RLU. Tento způsob měření je možné využít i při terénním hodnocení, k dispozici je nutné mít např. v plastovém provedení filtrační sestavu s ruční vakuovou pumpou s manometrem (dodává f. Merck, např.). Metoda měření ATP je metoda citlivá a může se uplatnit při monitoringu mikrobiologické kvality pitné vody v distribučním systému. Je možné ji považovat i za test znečištění, protože detekuje nejen mikrobiální znečištění, ale i přítomnost organické hmoty, sloužící jako substrát pro následné zachycení a pomnožení mikroorganismů. Systém měření pomocí LuciPacW je možné využít i v terénu, pokud je k dispozici přenosné filtrační zařízení s ruční vakuovou pumpou a jednorázově balené filtry. Varovným signálem přítomné kontaminace ve 100 ml přefiltrovaného vzorku je již úroveň RLU 50 (hodnota vychází z námi uskutečněných testů se vzorky vody uměle obohacené mikrobiální kontaminací v řádech 102 až 103 KTJ v ml). Při zvýšené kontaminaci je možné usuzovat i na hodnotě RLU 25 zjištěné ze stěru při filtraci 10 ml vzorku. I tato úroveň je pouze ilustrační a rozhodně nemusí ve všech případech znamenat, že pokud je detekováno RLU 25 v 10 ml vzorku (po filtraci na membránovém filtru) anebo RLU 50 ve 100 ml (po filtraci na membránovém filtru), pak se jedná přímo o výskyt patogenních a hygienicky významných mikroorganismů v pitné vodě. S tímto systémem a nastavením rizik je potřeba pracovat velmi opatrně, ostatně jak tomu nasvědčují zjištěné výsledky měření.
Metoda H2S strip test představuje velmi jednoduchý screeningový test na zjištění přítomnosti fekálního znečištění vody, který je založený na detekci sulfanu produkovaného bakteriemi. Sulfan produkují zástupci čeledi Enterobacteriaceae a také například sulfát redukující bakterie (Clostridium perfringens). Pro tento typ testu je potřebná kultivace vzorku v laboratoři, vzorek se inokuluje do peptonové vody (Fluka 70179) ve zkumavce, nezbytná je jistá mikrobiologická zkušenost s volbou adekvátně použitého poměru kultivačního média a vzorku (což výrobce neuvádí). V naší laboratoři se osvědčil poměr objemu peptonové vody a vzorku vody (neředěného, při úvaze kontaminace vody v řádech 102 KTJ v ml) např. 5:5, 5:3, 10:2. Mezi zátku a vnitřní stěnu zkumavky se umístí detekční strip a kultivuje se při teplotě 35 °C až 38 °C. Přítomnost bakteriální populace se projeví již po pár hodinách jemným zákalem peptonové vody a přítomnost bakterií se schopností produkce sulfanu se projeví černým zabarvením stripu papíru již po 18 h. Metoda H2S strip test je metoda velmi jednoduchá a účinná ve zjištění přítomnosti fekálního znečištění vody, nicméně je nevhodná z pohledu operativního přístupu v řešení přítomného mikrobiálního znečištění v distribučním systému. Po 18 h je potvrzena kontaminace metodou Colilert dokonce i kvantitativně.
LIVE/DEAD® BacLightTM Bacterial Viability Kit (Molecular Probes, L-7012) je možné použít pro zjištění přítomnosti bakterií ve vzorku (do jisté míry, po zkoncentrování biomasy) a současně pro odlišení živých buněk od mrtvých. Výhodou je rychlá aplikace barviv a vizualizace fluorescenčních produktů (povrchové značení, značení intracelulárních organel apod.). Kity lze aplikovat ke vzorkům čistých či směsných kultur (např. z exponenciálně rostoucích kultivací) a přírodním vzorkům, byly využívány i pro systém hodnocení kontaminace ve vodách. Detekcí se bohužel nezjistí typ bakterie a kontaminantu, ale pouze vitalita/mortalita objektu (bakterie). Nadstavbou ve fluorescenčním značení je využití metody průtokové cytometrie (FCM, flow cytometry). Metodou průtokové cytometrie je možné ve vodě kvantifikovat nejen množství bakterií, ale i jejich fyziologický stav, a to ve velmi krátkém čase. Limitujícím faktorem je nemožnost detekce a kvantifikace konkrétních skupin mikroorganismů. Pokud jde o parametry fyziologického stavu, které jsou ukazatelem životaschopnosti/aktivity buňky, lze měřit např. integritu bakteriální membrány, metabolickou či respirační aktivitu buněk, jejich membránový potenciál a další. Jedním z nejčastěji prováděných stanovení je právě detekce membránové integrity bakterií, ke které se vedle nespecifických fluorescenčních barviv využívají také barviva specifická, schopná vstupovat do buňky a vázat se na její nukleové kyseliny pouze tehdy, má-li buňka poškozenou buněčnou membránu. Typickým příkladem takového barviva je propidiumiodid vykazující výraznou fluorescenci v červené oblasti optického spektra. Buňky s poškozenou buněčnou membránou jsou obecně považovány za mrtvé, protože nejsou schopny dlouhodobě odolávat škodlivým vlivům z prostředí ani se množit a dříve nebo později jsou odsouzeny k buněčné lyzi. Potenciál využití průtokové cytometrie pro online monitoring kvality pitných vod je podložen mnoha studiemi [2].
Polymerázová řetězcová reakce (PCR) je citlivá metoda pro zjištění bakteriální kontaminace pitných vod, ale její provádění je směrováno na opravdu erudované pracoviště, nikoliv běžné provozní laboratoře. PCR slouží k detekci a jako mezistupeň při identifikaci mikroorganismů. Během PCR dochází k rychlému pomnožení vybraného úseku DNA, jehož syntéza je řízena krátkými oligonukleotidy (tzv. primery). PCR umožňuje detekci jediné kopie DNA ve vzorku tím, že tuto sekvenci namnoží do té míry, že je ji možno po separaci gelovou elektroforézou a obarvení snadno detekovat. Úspěšnost PCR do značné míry ovlivňuje kvalita vstupního materiálu. Je možné použít komerčně dostupné izolační soupravy (kity), jejichž výhodou je časová nenáročnost a většinou snadnost provedení, nevýhodou je finanční nákladnost. Izolace DNA ze vzorků vody lze provést pomocí RapidWater a PowerWater DNA izolačních kitů (MO BIO) [3].
Některé z výše jmenovaných metod jsou účinně používány na vzorky odpadních vod, sedimentů, biofilmů apod. V případě pitných vod může nastat komplikace v podobě nutnosti zkoncentrování vzorku, proto se pro věrohodný a jednoznačně mikrobiální kontaminaci identifikující monitoring zatím nedoporučují.
3. Biosenzory jako účinné nástroje včasného monitoringu kontaminace
S ohledem na výše zmíněnou problematiku obtížné rychlé detekce mikrobiální kontaminace, ve smyslu hygienické závadnosti pitné vody, se vědecko-výzkumný zájem orientuje na vývoj vysoce citlivých biosenzorů, které jsou schopny poskytnout požadovanou informaci s vysokou detekční citlivostí rychle a v reálném čase. Naše pracoviště se ve spolupráci s Ústavem chemie přírodních látek podílí na řešení projektu FV10312 Biosenzory pro detekci bakteriální kontaminace pitné vody, jehož snahou je vyvinout a zavést již zmíněný online měřící systém zaznamenávající mikrobiální znečištění v reálném čase.
Co si představit pod biosenzorem? V podstatě se jedná o přístrojový systém složený ze dvou základních komponent, a to z rozpoznávajícího biologického elementu se specifickou vazebnou afinitou k cílovému analytu a z transduktoru, který převádí specifickou vazebnou událost ve fyzikálně měřitelnou veličinu. Rozpoznávací element mohou tvořit na povrchu transduktoru ukotvené senzorové biomolekuly, jako jsou protilátky, peptidy, sacharidy a DNA oligonukleotidy. Z pohledu transduktoru jsou nerozšířenější foto-krystalické biosenzory transformující vazebnou událost jako změnu fluorescence nebo fungují na principu povrchové plasmonové rezonance. Hlavní nevýhody této techniky spočívají v požadavku na specializovaný personál, vysoké náklady na vybavení a prostorovou náročnost současných přístrojů. Dále jsou to piezoelektrické a elektrochemické senzory. Piezoelektrické senzory jsou založeny na sledování změn rezonanční frekvence na křemenném krystalu a její transformace indukované hmotností změněnou na jeho povrchu v důsledku interakce s cílovým analytem. Další poměrně rozsáhlou skupinou jsou elektrochemické senzory, které monitorují změny elektrického pole způsobené interakcemi na rozhraní senzoru a vzorku [4].
V projektu FV10312 se zabýváme vývojem a aplikací ultracitlivých elektrochemických biosenzorů, které budou selektivní k buněčnému povrchu různých bakteriálních kmenů. Jelikož je bakterie Escherichia coli indikátorový organismus v hygieně vody, byla zvolena jako modelový organismus pro vývoj biosenzoru. Pro detekční účely E. coli jsme zvolili perspektivní senzorové molekuly glykosidů odvozených D-manózy a antibakteriální peptid Magainin I se specifickou vazebnou afinitou ke jmenované bakterii. Jako negativní kontrola byl zvolen peptid SA5-1 s afinitou k S. Aureus. Jako další vektorová molekula byla zvolena mannosa a od ní odvozený C-glykosid, neboť E. coli prezentuje na povrchu lektin rozpoznávající s vysokou selektivitou D-mannopyranosový strukturní motiv. Jako negativní kontrola byly zvoleny glykosidy odvozené od D-fukózy s afinitou k A. fumigatus. Lektiny jsou proteiny vyskytující se na povrchu bakterií, které dokáží specificky rozpoznávat a vázat cukry, čímž v mnoha případech zprostředkovávají adhezi bakterií k hostitelské buňce [6]. V současné době se projekt nachází ve fázi testování specificity připravených preparátů senzorových molekul. Ty biomolekuly, jejichž citlivost a specificita bude dostatečná, budou dále využity pro sestavení kompletního biosenzoru a ten nakonec použit k testování v reálném prostředí. Cílovým organismem je bakterie Escherichia coli (kmeny CCM 3954; patogenní E. coli O157:H7 CCM 4787), pro kterou se fluorescenčně značené senzorové molekuly (Bodipy, Cy5) sacharidů a peptidů připravují a následně testují. Mikroskopické vyhodnocení signálu probíhá na epifluorescenčním a konfokálním mikroskopu.
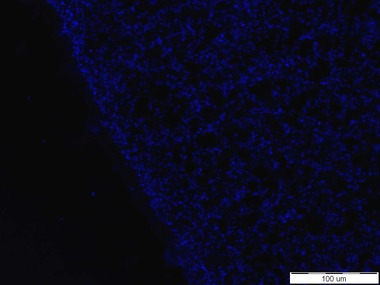
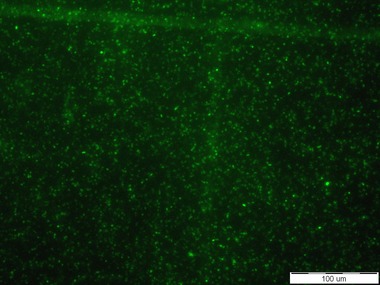
Testované senzorové molekuly označené fluorescenční značkou Cy5 se při mikroskopických zkouškách s čistými kulturami Escherichia coli CCM 3954 a CCM 4787 bohužel neosvědčily (viz Obr. 1). Byly zkoušeny různé způsoby přípravy preparátů, včetně použití tzv. negativní kontroly postupu, kterou byla bakterie Staphylococcus aureus CCM 3953, aby se eliminovala případná chyba v metodice. Nicméně signál poskytovaly pouze nečistoty v mimobuněčném prostoru, resp. partikule pocházející pravděpodobně z přípravy senzorových molekul. Nakonec bylo konfokálním mikroskopem potvrzeno, že afinita senzorových molekul označených Cy5 je k buňkám bakterií nulová a vznikající vazby jsou značně nespecifické. Proto byly tyto biomolekuly vyhodnoceny jako nevhodné k dalším postupům.
Obr. 1: Nulová afinita senzorové molekuly založené na O-glykosidu manno konfigurace s Cy5 k buňkám Escherichia coli. Vlevo: buňky E. coli CCM 3954 zviditelněné fluorescenční sondou DAPI, vpravo: signál poskytující zmíněná senzorová molekula
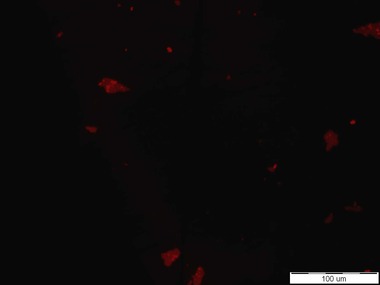
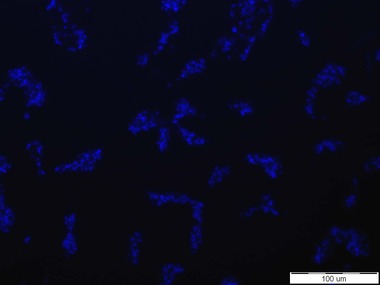
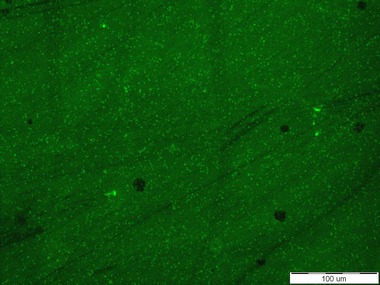
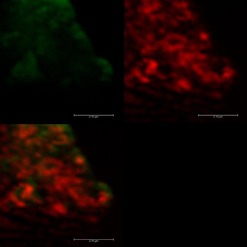
Senzorové molekuly označené pomocí fluorescenční značky Bodipy poskytovaly na první pohled určitý pozitivní signál v přítomnosti obou testovaných kmenů Escherichia coli. Pod epifluorescenčním mikroskopem byl pozorován signál připomínající spíše šum (viz Obr. 2). Oproti tomu, pod konfokálním mikroskopem byly signály buněk vidět intenzivněji než pod epifluorescenčním mikroskopem, nicméně některé buňky fluoreskovaly jen pod DAPI filtrem a jiné jen pod Bodipy filtrem. Otázkou tedy je, zda se tato dvě barviva mohou nějak vzájemně ovlivňovat. Při pozorování živých preparátů byly bohužel spatřovány také signály k buňkám Staphylococcus aureus, které vypovídají o nedostatečné specificitě testovaných látek (viz Obr. 3). Z tohoto důvodu byla připravena senzorová molekula na bázi fluorescenční značky Bodipy. Jelikož samotná Bodipy se v testovaném prostředí prakticky nerozpouští, byla zvýšena hydrofilita navázáním definované polyethylenglykolové hydrofilní domény. V případě pozitivní reakce v přítomnosti testovaných buněk, bude prokázána nespecifická interakce samotné fluorescenční značky s analytem.
Obr. 2: Signál senzorové molekuly založené na C-glykosidu manno konfigurace s BDP k buňkám Escherichia coli. Vlevo: buňky E. coli CCM 3954 zviditelněné fluorescenční sondou DAPI, vpravo: signál/šum poskytující zmíněná senzorová molekula
Obr. 3: Pozitivní signály poskytující senzorová molekula založená na O-glykosidu manno konfigurace s BDP k buňkám Escherichia coli CCM 4787 (vlevo) a k buňkám Staphylococcus aureus CCM 3953 (vpravo)
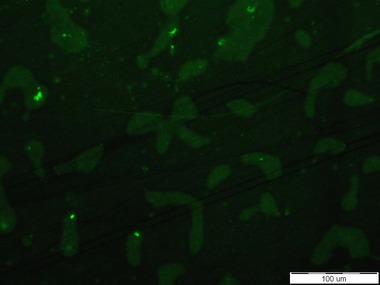
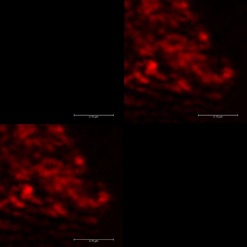
Jako další způsob, který bychom prokázali interakce fluorescenčního barviva Bodipy, byly nově připraveny totožné sacharidové, případně peptidové senzorové molekuly s navázanými nanodiamanty jako prvkem fluorescence. Fluorescence je způsobena přítomností N-V center, která byla vytvořena ozářením nanodiamantových částic ? částicemi na mikrotronu a následným žíháním povrchů ND [7]. Výhodou nanodiamantů oproti fluorescenčním značkám je jejich stálá luminiscence, tedy schopnost nevysvěcovat se. Ta byla u připravených nanodiamantů dokázána pomocí kolokalizace na konfokálním mikroskopu (viz Obr. 4). Další výhodnou vlastností nanodiamantů je jejich inertní charakter, kde nedochází k nespecifickým interakcím jak s analytem, tak se samotnými buňkami. Jako negativní kontrola budou použity nanodiamanty bez navázané specifické senzorové molekuly. Díky tomuto postupu bude dalším testováním možné zjistit, co je příčinou nedostatečné specificity senzorových molekul. Zda nebyla způsobena chyba pouze v nevhodném výběru či navázání fluorescenčních značek.

Obr. 4: Kolokalizace nanodiamantů s navázaným fluorescein aminem (FAM) po ozáření laserovým paprskem (červený čtverec) – nahoře vlevo: stálá luminiscence nanodiamantu, nahoře vpravo: ztráta luminiscence fluorescenčního barviva fluorescein aminu, dole vlevo: sjednocení horních obrázků
Obr. 5: Kolokalizace nanodiamantů s navázaným fluorescein aminem (FAM) před a po ozáření laserovým paprskem – nahoře vlevo: luminiscence fluorescenčního barviva fluorescein aminu, nahoře vpravo: stálá luminiscence nanodiamantu, dole vlevo: sjednocení horních obrázků
4. Závěry
Řešený projekt představuje značný potenciál pro uchopení řešení problému nejen rychlé detekce mikrobiální kontaminace, ale i online zjištění stavu kvality dodávané pitné vody v souladu s Rizikovou analýzou (HACCP, Water Safety Plans). Online biosenzor v detekci kontaminace bude možné velmi efektivně využít při provozním monitoringu, při odstávce, opravách, manipulacích a haváriích na distribuční síti. Před jeho uvedením do vodárenské praxe bude muset proběhnout ještě mnoho testů a zkoušek, které se týkají vývoje biosenzorů a interpretace zjištění výsledků, pozitivních signálů a jejich aproximaci na výsledky z laboratořemi rutinně prováděných kultivačních stanovení. Důležité je připomenout, že online systém tohoto typu, detekuje přítomné buňky bakterií, jejichž počet, detekovaný v odebraném vzorku (objem 10 ml nebo 100 ml) nemusí rozhodně odpovídat (a nebude) počtu skutečně vykultivovaných kolonií na specifickém médiu. V mikrobiologické praxi je tento fakt rozhodující a v případě relevantního zástupného parametru bude jeho definování a limit pro správné a vhodné použití přístroje s online detekčním biosenzorem stěžejním a kritickým bodem.
Po nalezení dostatečně specifických senzorových molekul jsou plánovány laboratorní zkoušky se surovou pitnou vodou (přítomnost/nepřítomnost dezinfekčního činidla) a testy s pitnou vodou odebranou z reálného prostředí vodovodního řadu (přítomnost dezinfekčního činidla, organotrofních bakterií, korozních produktů apod.).
Do zkoušek budou zařazeny i kultivační metody s cílem verifikace postupu a zjištění určité korelace mezi zjištěnými počty cílových buněk bakterií (zde E. coli) v nominálním objemu a počty KTJ skutečně vykultivovaných kolonií bakterií. Tímto se chceme vyvarovat i případnému nesprávnému použití zařízení a interpretaci výsledků, jak tomu někdy bývá u metod založených na průtokové cytometrii.
Poděkování
Publikace vznikla v rámci řešení projektu TAČR FV10312 Biosenzory pro detekci bakteriální kontaminace pitné vody.
Financováno z účelové podpory na specifický vysokoškolský výzkum (MŠMT č. 21-SVV/2018).
Použitá literatura
- Kožíšek F. 2016. Mediálně známé havárie a epidemie na vodovodech v ČR v období 2014–2015. Jaké jsou jejich příčiny a co nám mají říci. Sborník konference Vodárenská biologie 2016, 3.–4. února, Praha ČR, Říhová Ambrožová J., Pecinová A. (Edit.), 34–41.
- Vejmelková D., Říhová Ambrožová J., 2016. Alternativní přístupy k rychlé detekci mikrobiální kontaminace pitných vod. Sborník konference Vodárenská biologie 2016, Praha 3.–4. února, Praha ČR, Říhová Ambrožová J., Pecinová A. (Edit.), 42–50.
- Vavrušková L., Kolář K., Kabátová J., Vejmelková D., Říhová Ambrožová J. 2016. Možnosti řešení alternativních metod při řešení výjimečných stavů mikrobiální kontaminace. Sborník konference Pitná voda 2016, Tábor 23. 5. – 26. 5. 2016, 241–246.
- Ledvina M. 2017. Biosenzory jako nástroj pro monitorování bakteriální kontaminace pitné vody v reálném čase. Sborník konference. Vodárenská biologie 2017, 1.–2. února, Praha ČR, Říhová Ambrožová J., Pecinová A. (Edit.), 30–33.
- Říhová Ambrožová J., Vejmelková D., Čiháková P. 2017. Technická mikrobiologie a hydrobiologie. 1. ed. Praha: VŠCHT, 2017, 165.
- Sharon, N. 2006. Carbohydrates as future anti-adhesion drugs for infectious diseases. Biochimica et Biophysica Acta (BBA)-General Subjects, 2006, 1760.4: 527–537.
- Remes, Z., Micova, J., Krist, P., Chvatil, D., Effenberg, R., Nesladek, M. 2015. N-V-related fluorescence of the monoenergetic high-energy electron-irradiated diamond nanoparticles. physica status solidi (a), 2015, 212.11: 2519–2524.
Microbial contamination of drinking water can be caused by various factors, i.e. failure of the treatment process, the human factor, the defect in the distribution network, etc. Currently culture techniques based on the detection of fecal pollution indicator organisms and determining the total number of microorganisms are used as “golden” standard. These methods, however, are limited only to culturable organisms which comprise only a small percentage in the environment, and are quite time consuming. For this reason, researchers have been trying already for decades to find alternative methods, which in certain situations could substitute cultivation methods. Within the project FV10312 Biosensors for detection of bacterial contamination of drinking water, a number of biosensors (“sensor molecules”) have been synthesized and tested for their specificity to the cell surface of E. coli.