Mikrobiální mikroklima budov (II)
Sběr a kultivace vzorků z rodinných domů
Tento díl se zaměřuje na problematiku sběru vzorků pro analýzu mikrobiální kontaminace prostředí v rodinných domech v okolí Brna. Cílem bylo vytipovat vhodné metody, které jsou v praxi použitelné, přiměřeně nákladné a dobře popisují stav kontaminace prostředí, aby bylo možno nejen zhodnotit kvalitu vzduchu, ale také hledat příčiny zjištěného stavu. Šetření bylo provedeno v domech vybavených vzduchotechnikou a pro porovnání také v domech s přirozeným větráním.
1 Úvod
V prvním díle byla obecně představena problematika mikrobiálního mikroklimatu budov a také skutečnost, že v České republice platí závazná vyhláška pro pobytové místnosti staveb [1], která předepisuje, že v pobytových místnostech (veřejných staveb, ale hygienická pravidla mají jistě obecnou platnost) je nepřípustný viditelný nárůst plísní na zdech a površích. Za prokázaný růst plísní na povrchu se ve sporných případech považuje i nález potvrzený odběrem a kultivací na živné půdě – tj. i množství okem neviditelné, může být hodnoceno jako závadné. Dále je předepsáno, že mimo prostory vyžadující zvýšené nároky na čistotu je stanovena maximální koncentrace bakterií 500 KTJ (kolonie tvořící jednotky)/m3 vzduchu a maximální koncentrace plísní rovněž 500 KTJ/m3 vzduchu. Jak bylo uvedeno minule, tyto koncentrace korespondují s celoevropským průměrem. Přestože nejsou tyto limity předepsány pro bytové prostředí, z podstaty věci vyplývá, že v bytovém prostředí tráví člověk hodně času a tudíž expozice jakýmikoli škodlivinami je zde dlouhodobá a ze zdravotního hlediska významná. Víme však, jsou-li tyto limity splněny? Jedním ze zásadních technických prostředků jak vytvořit kvalitní vnitřní prostředí je nucené větrání vybavené filtrací vzduchu. Prvotním důvodem pro instalaci nuceného větrání v bytové výstavbě je samozřejmě úspora tepla použitím jeho zpětného získávání nejčastěji výměníkem vzduch/vzduch, ale další aspekty vzduchotechniky by neměly být opomíjeny. Je vzduchotechnika přínosem, nebo naopak přítěží z hlediska mikrobiální složky vnitřního vzduchu? Pro odpověď na tuto otázku jsme provedli šetření ve skupině 10 rodinných domů na jižní Moravě.
1.1 Okrajové podmínky měření
![Obr. 1 – Sezonní výkyvy koncentrace plísní ve venkovním ovzduší v jižním Rakousku [2]](/docu/clanky/0129/012972o1.png)
Obr. 1 – Sezonní výkyvy koncentrace plísní ve venkovním ovzduší v jižním Rakousku [2]
Odborná literatura uvádí, že koncentrace plísní v interiérech se pohybuje v širokém rozmezí a významně se odvíjí od koncentrace plísní ve venkovním vzduchu. Ve venkovním ovzduší se plísně vyskytují zejména v létě a na podzim, když je teplo a vlhko. Na obr. 1 je znázorněna průměrná hodnota, rozptyl a max. a min. hodnoty zjištěné během roku ve Štýrsku v jižním Rakousku. Pozorování z jiných evropských i mimoevropských lokalit ukazují, že celosvětově převládají rody Cladosporium, Aspergillus a Penicillium a jejich časové rozložení je podobné [2].
Jak je vidět, nejlepší stav ovzduší je v zimě a na jaře, kdy nepříznivé nízké teploty brání přežívání spór plísní ve vzduchu. Také je vidět, že splnění limitu 500 KTJ/m3 v letním období je v budovách s přirozeným větráním za běžných vnějších podmínek nereálné. Z tohoto důvodu se naše šetření odehrávalo na jaře, kdy je přirozené pozadí nízké.
Další podmínky, které je třeba pro porovnávání výsledků zaznamenat, souvisí s polohou, velikostí, vybavením a užíváním domu. Získáme tak informace o vlastním prostředí, ve kterém je sběr prováděn. Je nezbytné zaznamenat hodnoty, jako jsou teploty, relativní vlhkosti vzduchu i povrchů, ze kterých je vzorek odebírán, a další související faktory, jako např. přítomnost domácích mazlíčků, četnost úklidu, znečištění oklního exteriéru a další (více viz [3]). Proměnlivost výskytu sledovaných škodlivin je velmi odlišná, a to nejen mezi budovami (i sousedními), ale také mezi jednotlivými místnosti ve stejném domě (bytě), ba dokonce v jedné místnosti v průběhu dne. Bez těchto záznamů tedy nebudeme schopni relevantně porovnávat výsledné hodnoty. Měření a hodnocení bude realizováno ve dvou samostatných kategoriích, pro plísně a bakterie.
2 Metody sběru dat o mikrobiálním znečištění
Z hlediska expozice člověka je zásadní výskyt mikroorganismů ve vdechovaném vzduchu. Tato hodnota je ovšem s počasím, provozem budovy, větráním a proměnlivými vnitřními zdroji značně kolísavá. Proto se také sleduje výskyt mikroorganismů na površích nebo v prachu, který je většinou jejich zásobárnou. Poměrně rozsáhlý popis možností sběrů vzorků je podrobněji rozebrán v [3]. Jsou zde také porovnány výsledky různých měření a je upozorněno na skutečnost, že samotná technika sběru a použité přístroje mají vliv na výsledek, tudíž lze výsledky různých pracovních skupin obtížně srovnávat. Tradiční metody spočívají ve zjištění počtu životaschopných jednotek, tedy těch, které jsou schopny se za příznivých podmínek rozmnožovat. Metody se dělí na:
- aktivní, kdy se vzduch nasává nuceně tak, aby částečky ulpěly na živné půdě a
- pasivní, které využívají volného pohybu spor plísní a bakterií ve vzduchu a jejich samovolného usazování na živnou půdu, případně na různé povrchy, ze kterých lze usazený bioaerosol odebrat.
Následně se mikroorganismům vytvoří vhodné prostředí pro růst (jsou stanoveny teploty a kultivační doba). Po kultivaci se vyhodnotí kvantitativně počet kolonií, příp. druhová skladba. Aby byly vytvořeny vhodné podmínky pro obě sledované skupiny, jsou živné půdy odlišné pro plísně (vláknité mikromycety) popř. kvasinky a bakterie.
2.1 Stanovení množství mikroorganismů ve vzduchu [KTJ/m3]
Vyhláška [1] uvádí, že odběr vzorku vzduchu se provádí aeroskopem podle standartního operačního postupu uvedeného v příloze a kultivací na živné půdě. Předpis popisuje přípravu prostor, jejich nutnost vyvětrání a omezení provozu, a to jak nuceně, tak přirozeně větraných, a následně postup a umístění aeroskopu při vlastním odběru. Metoda aktivního nasávání vzduchu aeroskopem je zatím jediná varianta, která je dle uzákoněných předpisů porovnatelná s limitní hodnotou, kdy za vyhovující se považuje, nepřekročili vzorek limit 500 KTJ/m3.
Aeroskop je zařízení, které pomocí zabudovaného ventilátoru nuceně nasává vzduch ve zkoumaném prostředí, a částice obsažené v nasávaném vzduchu jsou zachyceny na živné půdě. Princip odstředivého aeroskopu je na obr. 2.
![Obr. 2a – Odstředivý aeroskop, nasávané částice jsou odstředivou silou unášeny k agarovému stripu (pásku) po obvodě hlavy [4]](/docu/clanky/0129/012972o2.jpg)
Obr. 2a – Odstředivý aeroskop, nasávané částice jsou odstředivou silou unášeny k agarovému stripu (pásku) po obvodě hlavy [4]
![Obr. 2b – Aeroskop připravený k použití [4]](/docu/clanky/0129/012972o3.jpg)
Obr. 2b – Aeroskop připravený k použití [4]
Toto měření jsme prováděli, protože se jedná o stěžejní parametr stavu vzduchu v místnosti pro hlavní obytnou místnost v rodinném domě, běžně obývací pokoj s kuchyňským koutem, a pro jednu méně zatíženou místnost, nejčastěji dětský pokoj. K tomu jsme samozřejmě pro úplnost provedli odběr také ve venkovním prostředí, vždy samostatně pro celkové počty mikroorganismů (zejména bakterií) CPM a pro plísně. Rozhodli jsme se pro měření v uzavřené místnosti v dýchací zóně bez toho, aby místnost byla předem vyvětrána, neboť chceme postihnout situaci takovou, jaká reálně v domě je. V případě, že místnost disponuje nuceným větráním, bylo vždy zapnuto, aby bylo možné vliv provozu vzduchotechniky postihnout.
2.2 Stanovení počtu mikroorganismů na površích [KTJ/m2]
Toto měření umožní identifikovat zejména zatížení stěn nebo kritických stavebních detailů plísněmi, což je užitečné ve sporných případech, kdy nárůst plísní není viditelný, ale zvýšená vlhkost zdiva umožňuje vhodné podmínky pro osídlení. Odběr vzorku je možný otiskem nebo stěrem vlhkou houbičkou či tamponem z určité plochy. My jsme se zaměřili na monitoring stavu prvků vzduchotechniky, která už i v rodinných domech není zcela ojedinělá. Sledovali jsme výskyt mikrobů na vnitřních površích vzduchotechnické jednotky a na koncových elementech rozvodů vzduchu v interiéru. Aby bylo možné odebírat vzorek i tvarově složitější plochy, používali jsme měkké houbičky. Vlastní houbička je napuštěna roztokem podporující životaschopnost mikroorganismů a je sterilně zabalena.
Velmi podstatným údajem je stanovení velikosti odběrové plochy. Ta musí být dodržena u všech jednotlivých stěrů. Jako vhodné se jeví vytvořit si šablony (rámečky), případně různé tvary šablon, které mají tuto plochu pevně danou a nemůže tak dojít k nepřesnostem v jednotlivých odběrech. Dále se jako vhodné jeví odebrat tyto stěry na více místech a především na těch, která jsou podezřelá z přítomnosti plísní, či bakterií (viditelný růst mikroorganismů, chladné a vlhké plochy). Vlastní odběr vzorku „stěr“ je třeba provádět tak, aby houbička nebyla kontaminována jinými částicemi, než jsou předem stanovené plochy. Ukázka odběru vzorků je na obrázcích 3 a 4. Vhodné je používat sterilní rukavice a dbát na rychlé provedení odběru vzorku. Po provedení stěru z definované plochy je zapotřebí odebraný vzorek (houbičku, tampon) opět neprodyšně uzavřít tak, aby nedošlo k další expozici jinými mikroorganismy. Nasbírané vzorky je třeba uchovat v chladu a co nejdříve je zpracovat.
2.3 Pasivní spadová metoda [KTJ/Petriho miska.čas]
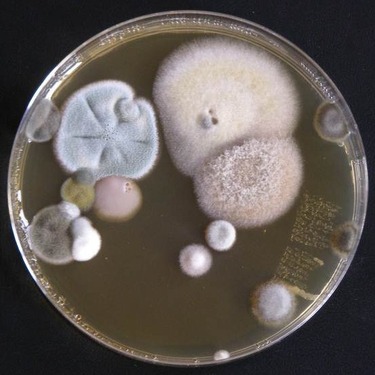
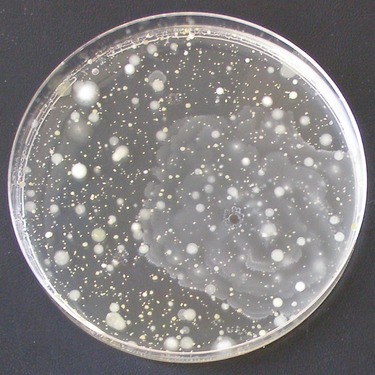
Tato nejstarší metoda používaná již v 19. století je založená na prosté sedimentaci bioaerosolu na živnou půdu, na které je následně kultivován. Jedná se o metodu velmi citlivou na proudění vzduchu v místnosti. Proto je třeba před započetím odběru vzorku zajistit, aby v místnosti nedocházelo k průvanu, či pohybu osob a případně zabránit dalšímu víření vzduchu ve sledovaném prostoru. Živná půda je nanesena na Petriho misce, což jsou mělké skleněné nebo plastové misky s volně přiléhajícím víčkem užívané v mikrobiologii již od 2. poloviny 19. století, pojmenované po německém bakteriologovi J. R. Petrim (asistentovi R. Kocha). Má průměr 9 cm a doba sběru se doporučuje mezi 10 a 30 minutami. Je natolik v mikrobiologické praxi zaběhlá, že se používá i jako míra plochy bez přepočítávání na běžné jednotky SI. Hmotné částice volně sedimentují na živnou půdu a jejich zachycené množství je samozřejmě na čase závislé, pro účely hodnocení prostředí v budovách se nejčastěji užívá doby 4 h.
Po odběru jsou misky opět uzavřeny, aby nedošlo k nežádoucí kontaminaci. Živné půdy v miskách zajišťují optimální přísun živin při kultivaci mikroorganismů. Živných půd je celá řada, liší se složením, účelem použití a selektivitou. Je třeba vždy u vzorků rozlišovat Petriho misky, na kterých budou vždy kultivovány bakterie nebo plísně. Tyto misky zpravidla obsahují odlišné živné půdy, které mohou inhibovat ostatní skupiny mikroorganismů. Sedimentaci na Petriho miskách jsme použili jako doplňkové měření stavu vnitřního vzduchu, v hlavní pobytové a jedné klidnější místnosti domu a také ve venkovním prostoru. Budeme rovněž v dalším sledovat, zda výsledky aktivní a pasivní metodou vzorkování vzduchu spolu korelují. Odborná literatura uvádí, že vzájemná souvislost je neprůkazná, což tímto dvojitým měřením můžeme ověřit, či za specifických podmínek vyvrátit.
Petriho misky s příslušnou živnou půdou jsou otevřeny až na místě provádění odběru, kde jsou vystaveny vždy po stejný časový interval zkoumanému prostředí a ponechány přirozenému průběhu sedimentace pevných částic. Doba expozice se musí uzpůsobit očekávanému množství mikroorganismů. U příliš krátkého času expozice bude počet životaschopných organismů vykultivovaných na živné půdě neprůkazně nízký a po dlouhé době naopak zase natolik mohutný, že nebude možné na miskách rozlišit jednotlivé kolonie. Ukázka vykultivovaných plísní a bakterií je prezentována na obr. č. 5. Po uplynutí času expozice je nutné Petriho misky opět uzavřít a co nejdříve umístit do optimálních kultivačních podmínek.
2.4 Stanovení koncentrace v prachu [KTJ/g]
Toto vyšetření je užitečné v případech, kdy se v prostředí vyskytuje větší množství prachu, který lze odebrat. Jeho složení je totiž podstatně stabilnější než aktuální stav vzduchu a literatura uvádí, že je též často výbornou živnou půdou pro mikroorganismy, zejména prach v domácnostech, který obsahuje organické nečistoty, šupinky lidské kůže apod. V 1 g domácího prachu se mohou nacházet tisíce životaschopných (kultivovatelných) mikroorganismů. Toto vyšetření jsme prováděli jen jako doplňkové, pro snímání málo prašných povrchů jsme využívali kontaktní otisky.
3 Kultivace a vyhodnocení vzorků
Celý proces kultivace plísní a bakterií je popsán v ČSN [6] a [7] a na tyto normy se odkazuje také Vyhláška č. 6 ze dne 16. prosince 2002 [1]. Kultivace živých organismů zachycených přímo na živných půdách (aeroskop, spad, otisky) probíhá přímo na této půdě. Pokud je vzorek odebrán na pomocný materiál, jakým je např. houbička pro stěry, nebo je odebrán vzorek prachu, je třeba vzorek vhodnou metodou uvolnit, naředit a následně na živnou půdu přenést. Těchto technik je více, což je opět důvodem, proč výsledky získané různými metodami nebo stejnými metodami s odlišným zpracováním nelze vzájemně porovnávat. Proto je nutné přistupovat při hodnocení opatrně s porovnáváním výsledků dosažených jinými autory. Při sběru i zpracování vzorků jsme tedy dbali na to, aby sběr prováděli stejní pracovníci, stejnou technikou, a zpracování vzorků bylo provedeno jednou laboratoří. Tím jsme dosáhli sice malého, za to však konzistentního souboru dat k hodnocení. Kultivaci vzorků a odborný dohled nad jejich zpracováním prováděli zaměstnanci pracoviště Mikrobiologie Ústavu agrochemie, půdoznalství, mikrobiologie a výživy rostlin Mendelovy univerzity v Brně. Aeroskopické měření prováděli pracovníci Zdravotního ústavu.
Kultivace bakterií
Zpracované vzorky určené pro kultivaci se umístí do biologického termostatu s teplotou nastavenou na 30 °C ±1 °C na dobu 72 hodin. Tam za daných podmínek při aerobní inkubaci vyrostou na příslušné živné půdě kolonie bakterií, které se následně spočítají.
Kultivace plísní
Zpracované vzorky se obdobně umístí do biologického termostatu, ovšem již s jinou teplotou, která je nastavena na 25 °C ±1 °C na 3–5 dnů. Po uplynutí inkubace se vzorky vyjmou a spočítají počty kolonií tvořících jednotky.
Vyhodnocení
Vlastní vyhodnocení již kultivovaných vzorků se provádí např. pomocí čítačů kolonií, viz obr. 6.
4 Závěr
Článek popisuje postup, jakým je možné vytvořit soubor vzorků a následně dat, ze kterých je možné získat obraz o stavu sledovaných prostor. Je zde snaha poukázat na nutnost předem stanovit pevná pravidla, jako časové intervaly expozice Petriho misek, místa a počet odběrů a další okrajové podmínky, bez kterých jinak není možné vzorky získané z různých budov porovnávat. Odborná literatura, která se touto problematikou zabývá, je dominantně zahraniční a její autoři jsou mikrobiologové. Najdeme zde poměrně rozsáhlé soubory dat s odpovídajícím statistickým zpracováním, kvantifikaci a identifikaci zachycených mikroorganismů, ovšem údaje o prostředí, ze kterého byly odebrány, jsou poměrně kusé. Nejvýše se dozvíme materiálové řešení konstrukčního systému, ale o způsobu větrání, vytápění a dalších technických aspektech velmi málo. Naše šetření přispívá k současnému vědění tím, že právě tyto aspekty zdůrazňuje a hledá v nich souvislosti.
Literatura
- [1] Česko; Vyhláška č. 6 ze dne 16. prosince 2002, kterou se stanoví hygienické limity chemických, fyzikálních a biologických ukazatelů pro vnitřní prostředí pobytových místností některých staveb. In: Sbírka zákonů č. 6/2003, částka 4. Dostupné z: http://aplikace.mvcr.cz/sbirka-zakonu/
- [2] HAAS A., HABIB J., LUXNER J. a kol; Comparison of background levels of culturable fungal spore
- concentrations in indoor and outdoor air in southeastern Austria in Atmospheric Environment 98 (2014), str. 640-647
- [3] WANNER H. a kol.; EUR 14988 - Enviromnment Institut: Indoor air quality & int impact on man, No. 12 Biological Particles in Indoor Environments; Commission of the european communites; 1993 Luxembourg, Zdroj:
http://vetrani.tzb-info.cz/vnitrni-prostredi/12819-mikrobialni-mikroklima-budov-i - [4] Labpak; AirSampler,. Dostupné z https://www.prlabs.co.uk/news/downloads/K9FweVWR%20Surface%20Air
- [5] ČSN ISO 7954. Mikrobiologie. Všeobecné pokyny pro stanovení počtu kvasinek a plísní. Technika počítání kolonií vykultivovaných při 25 °C.
- [6] ČSN EN ISO 4833. Mikrobiologie. Všeobecné pokyny pro stanovení celkového počtu mikroorganismů. Technika počítání kolonií vykultivovaných při 30 °C.
Příspěvek vznikl za podpory specifického výzkumu VUT FAST-S-15-2620 a vědeckého centra Admas.
Posuzovaná práce se věnuje aktuálnímu problému mikrobiální kontaminace obytných prostor a metodám jak míru této kontaminace zjišťovat. Jsou zde popisovány standardní metody analýzy mikrobiální kontaminace vzduchu a dále metody stanovení kontaminace různých povrchů. Autoři se snaží stručnou a srozumitelnou formou seznámit ne úplně zasvěceného čtenáře s touto do jisté míry složitou problematikou.
This part focuses on the issue of collecting samples of the microbial environment in the houses near Brno. The aim is to find suitable methods that are applicable in practice, reasonably expensive and describe well the state of the microbial element of environment, in order not only to evaluate air quality, but also to find the source of detected state. Investigations were carried out in houses equipped with air condition and also compared with natural ventilation.

 Obr. č. 3. – Odběr stěru na definované ploše stěny s pomocí šablony a z talířového ventilu
Obr. č. 3. – Odběr stěru na definované ploše stěny s pomocí šablony a z talířového ventilu