Oxid uhličitý a možnosti jeho využití I
fyzikální a chemické vlastnosti a jejich využití v praxi
O oxidu uhličitém se v současnosti nejčastěji hovoří jako o obtížném odpadu, kterého je třeba se nějak zbavit. Jedná se přitom mnohdy o diskutabilní návrhy (například CCS) spojené s vysokými náklady a nejistým efektem. Racionální přístup v duchu moderních trendů však představuje snaha o jeho materiálové využití. První část článku představuje základní vlastnosti a přehled tradičních možností technického využití oxidu uhličitého.
1. Úvod
Oxid uhličitý je v současné době snad mediálně nejznámějším plynem. Zasloužila se o to především neustále probíhající živá diskuse o změnách v klimatickém systému Země, jejich příčinách, o skutečných i domnělých následcích.
Na druhou stranu je třeba si uvědomit, že oxid uhličitý se svým aktuálním objemovým obsahem zhruba 385 ppm v zemské atmosféře umožňuje život na Zemi v podobě, v jaké jej známe. Bez existence skleníkového efektu, na němž se podílejí i některé další plyny, by průměrná teplota byla přibližně o 33 °C nižší [1]. Oxid uhličitý je součástí přirozených přírodních a biochemických cyklů (koloběh uhlíku, energetické procesy v živých organismech apod.). Je dobré mít na paměti, že na uhlíku, resp. jeho organických sloučeninách, je založen veškerý pozemský život. Obsah oxidu uhličitého v atmosféře se zároveň jako jeden z celé řady rozličných faktorů podílí na ovlivňování vývoje zemského klimatu.
Oxid uhličitý je obsažen především v kouřových plynech z různých druhů spalovacích procesů a vzniká rovněž jako odpad z řady chemických výrob (zpracování uhlí, ropy, zemního plynu, výroba páleného vápna aj.) i z fermentačních procesů. Zároveň uniká do atmosféry obrovské množství při různých biologických procesech v přírodě, zpravidla však v rozptýlené formě.
O tomto plynu se v současnosti nejčastěji hovoří jako o obtížném odpadu, kterého je třeba se pouze nějak zbavit. Jedná se přitom mnohdy o diskutabilní návrhy spojené s vysokými náklady a nejistým efektem. Racionální přístup v duchu moderních trendů však představuje snaha o jeho materiálové využití. Zajímavé fyzikální a chemické vlastnosti oxidu uhličitého jsou základem pro různé technické i chemické aplikace, které naopak mohou přispět k ochraně životního prostředí, lidského zdraví a do budoucna i úspoře či náhradě fosilních surovin. Třetí možností je pak využití v biologických kultivačních procesech (podpora fotosyntézy). Při úvahách o možném alternativním využití oxidu uhličitého se sluší realisticky podotknout, že celkově vznikající množství tohoto plynu jsou tak obrovská, že v různých výše zmíněných aplikacích se může uplatnit jen jeho relativně malá část. Jiná situace v těchto relacích by ovšem mohla nastat ve vzdálenější budoucnosti, kdy je nutno počítat s tím, že bude k dispozici jen oxid uhličitý z biologických procesů a spalování biomasy, příp. doplněný plynem získaným rozkladem uhličitanových hornin nebo separovaným z atmosféry.
2. Fyzikální vlastnosti oxidu uhličitého
Oxid uhličitý je za normálních podmínek bezbarvý plyn bez chuti a zápachu. Od ostatních plynů, vyskytujících se v atmosféře, jej odlišují dvě významné vlastnosti [2]: trojný bod (teplota 216,6 K, tlak 5,2 bar) a kritický bod (teplota 314,12 K, tlak 73,75 bar). Vzhledem k vysokému tlaku trojného bodu nemůže oxid uhličitý existovat v kapalném stavu za tlaku atmosférického, může být pouze ve skupenství plynném, nebo pevném (suchý led). Kritická teplota je však vyšší než teplota laboratorní. Lze tedy oxid uhličitý zkapalnit zvýšením tlaku i za normálních teplot. Při teplotě přesahující teplotu kritickou nelze již plyn stlačením zkapalnit.
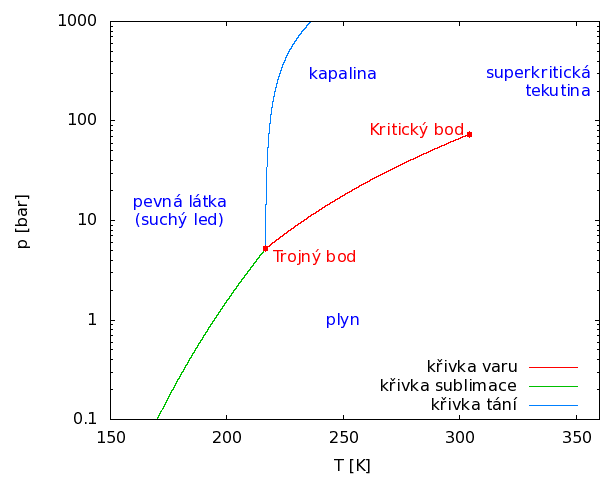
Obr. 1: Fázový diagram oxidu uhličitého
Stlačené tekutiny při teplotě těsně nad teplotou kritickou vykazují anomální vlastnosti. Jejich transportní vlastnosti (viskozita, difuzivita) se blíží vlastnostem plynů, zatímco hustota má hodnotu typickou pro kapaliny. Extrakční schopnost takové tekutiny je vyšší než extrakční schopnost stejné látky v plynném stavu, v jednotce objemu se rozpustí větší množství. Vzhledem k výhodnějším transportním vlastnostem oxid uhličitý snáze proniká do extrahovaného materiálu. Extrakce proto probíhá rychleji. Oddělení rozpuštěné látky od rozpouštědla docílíme snížením tlaku. Extrakce se provádějí obvykle při teplotách od 30 do 60 °C, takže nedochází k destrukci tepelně nestabilních látek.
3. Chemické vlastnosti oxidu uhličitého s příklady klasických aplikací
Chemické reakce jsou v článku uvedeny pouze schematicky především v sumární formě. Jednotlivé dílčí kroky jsou z důvodu rozsahu textu dále znázorněny jen výjimečně. Bližší informace mohou zájemci nalézt v příslušné odborné literatuře.
Oxid uhličitý se vyznačuje lineární molekulou. Ačkoli mají kovalentně vázaný uhlík a kyslík rozdílnou elektronegativitu, molekula se nechová jako dipól, protože se parciální náboje právě v důsledku uvedené lineární struktury ruší.
Molekula vykazuje značnou stabilitu. Teprve při záhřevu nad 2000 °C se rozkládá na oxid uhelnatý a kyslík:
Oxid uhličitý je za normálních podmínek poměrně málo reaktivní plyn, který se tak částečně podobá jiným chemicky více či méně netečným plynům jako např. dusík nebo inertní plyny. Výjimku tvoří acidobazické reakce, které mají i četné technické aplikace. Ve vodě se rozpouští a vytváří slabou nestabilní kyselinu uhličitou, na kterou připadá přibližně 0,2 % rozpuštěného plynu. Zbylý rozpuštěný podíl se chová jako hydratovaný plyn. Z uvedeného pohledu je vlastně oxid uhličitý anhydridem kyseliny uhličité.
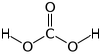
Kyselina uhličitá je dvojsytná a poměr jednotlivých disociovaných forem v roztoku závisí na konkrétních podmínkách (pH, teplota).
Ukázkou využití acidobazických reakcí oxidu uhličitého je po staletí využívaný princip tuhnutí vápenné malty, který lze vyjádřit jednoduchou rovnicí
Z moderních aplikací lze uvést např. neutralizaci alkalických odpadních vod z průmyslu, kde oxid uhličitý nahrazuje použití silných minerálních kyselin. Odpadá tak negativní efekt zasolení vod chloridy či sírany a eliminuje se nebezpečí překyselení i rizika a komplikace při manipulaci s kyselinami. Obdobnou reakci s roztoky alkalických hydroxidů, která je založena na chemické absorpci, lze využít k izolaci ze směsi plynů.
Chemické vlastnosti oxidu uhličitého se v průmyslové praxi využívají při známé výrobě sody Solvayovým postupem, jehož podstatu lze vyjádřit sumární rovnicí
Průběh některých reakcí je třeba podpořit vyšší teplotou a tlakem. Příkladem je např. výroba močoviny, probíhající při 230 °C a tlaku 180 bar, schematicky znázorněná jako
Produkt se používá při výrobě hnojiv, močovino-formaldehydových pryskyřic, léčiv i ve výrobě kosmetických přípravků apod. Za zmínku stojí i použití k redukci oxidů dusíku v kouřových plynech (metoda SNCR – Selective non catalytic reduction).
Příkladem jiné důležité průmyslové výroby je syntéza kyseliny salicylové (Kolbe-Schmittova syntéza, 120–140 °C, 5–6 bar) sumárně schematicky vyjádřená následovně:
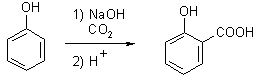
Produkt se následně využívá k výrobě kyseliny acetylsalicylové, jednoho z nejpoužívanějších léčiv známého pod různými obchodními názvy (aspirin, acylpyrin, aspro, upsarin apod.).
Z dalších výrob v oblasti organické chemie je možno zmínit syntézu cyklických karbonátů reakcí s epoxidy za současné katalýzy (ethylen- a propylenkarbonat). Jsou použitelné pro další syntézy nebo jako rozpouštědla při výrobě povlaků či jako elektrolyty v Li-iontových bateriích. Existují i příklady syntézy lineárních polykarbonátů s možností dalšího výraznějšího rozvoje.
Za vysokých teplot se oxid uhličitý účastní i oxidačně-redukčních reakcí, kdy se chová jako slabé oxidační činidlo. Reaguje tak např. s alkalickými kovy nebo kovy alkalických zemin:
Nejdůležitější reakcí z této kategorie je vysokoteplotní redukce oxidu uhličitého uhlíkem, jak se uplatňuje zejména při zplynování uhlí a při výrobě železa ve vysokých pecích:
Značně specifickou katalytickou reakcí, kde se oxid uhličitý v některých případech uplatňuje, je syntéza methanolu. Jedna z obvyklých technologií vychází ze syntézního plynu (směs oxidu uhelnatého a vodíku). Zde se buď oxid uhelnatý nahrazuje oxidem uhličitým nebo se k výchozí plynné směsi přimíchává oxid uhličitý s vodíkem. Tímto postupem se ve světovém měřítku vyrábí jen poměrně malá část uvedeného produktu:
Oxid uhličitý může také s vodíkem reagovat za podmínek, kdy dochází až k redukci na methan:
Tato tzv. Sabatierova reakce, která probíhá za vyšší teploty, tlaku a katalýzy niklem (nověji s vyšší účinností rutheniem na oxidu hlinitém), nabývá v poslední době nového významu v souvislosti s úvahami o akumulaci energie z obnovitelných zdrojů.
4. Fotosyntéza
Fotosyntéza má zásadní význam pro existenci vyšších forem života na Zemi. Jedná se o celý komplex redox reakcí, který lze velmi zjednodušeně vyjádřit sumární rovnicí:
Za spolupůsobení slunečního záření a chlorofylu tak vznikají energeticky bohaté sloučeniny. Účinnost tohoto procesu je poměrně nízká, ale jeho význam je vzhledem k masovému výskytu v přírodě obrovský. Je základním kamenem koloběhu uhlíku v přírodě, předpokladem produkce potravin a obnovitelných materiálových i energetických zdrojů.
Jednotlivé fáze fotosyntézy jsou předmětem výzkumu řady světových vědeckých pracovišť s ohledem na možné budoucí uplatnění v praxi. Jedná se např. o chemickou aktivaci oxidu uhličitého spojenou s katalytickým štěpením této termodynamicky stabilní molekuly, která je pak následně schopna se zúčastnit řady reakcí [3]. Tuto stručnou zmínku o fotosyntéze uvádíme jen pro doplnění, i když s chemickými aplikacemi oxidu uhličitého zdánlivě přímo nesouvisí. Ve skutečnosti však může výhledově výzkum těchto katalytických mechanismů otevřít cestu k novému doposud neznámému odvětví syntetické chemie.
5. Vybrané technické aplikace
Oxid uhličitý je využíván v řadě procesů, kde se uplatňují jeho fyzikální a chemické vlastnosti. Jednou z typických aplikací je vysokotlaká extrakce, ať již superkritická, nebo extrakce kapalným oxidem uhličitým při teplotě mírně podkritické. K oddělení rozpuštěné látky dochází snížením tlaku, vyhneme se tedy energeticky a časově náročné destilaci a sušení. Na druhou stranu je vysokotlaké zařízení investičně nákladné. Vysokotlaké extrakce tedy najdou uplatnění tam, kde lze využít jejich výhod. Jednou z oblastí je potravinářský průmysl, kde je nutno při zpracování zachovat vitamíny a jiné cenné látky, které jsou nestabilní při vyšších teplotách. Další výhodou je náhrada organického rozpouštědla, které může představovat zdravotní rizika, rozpouštědlem netoxickým a velmi těkavým. Vzhledem ke stabilitě molekuly oxidu uhličitého nedochází k chemické interakci s extrahovanými látkami. Rozpustnost látek v tomto médiu je tedy určena v podstatě bodem varu rozpouštěné látky, nikoliv její polaritou. Extrakční vlastnosti lze však upravit přídavkem malého množství jiného rozpouštědla. V potravinářských aplikacích se používá zejména voda a ethanol.
Nejznámějším procesem je extrakce chmele pro použití v pivovarnictví. Odhaduje se, že tímto postupem se získává polovina světové produkce chmelového extraktu. Další aplikací je odstraňování kofeinu z kávy a čaje. S výhodou se uvedená extrakce uplatňuje i při zpracování dalších přírodních materiálů, kdy se např. z koření a bylin získávají aromatické látky, éterické oleje apod.
Středem zájmu je i využití superkritické extrakce pro přípravu krystalického oxidu titaničitého [4], depozici nanovrstev pro aplikace v mikroelektronice [5], přípravu nanočástic β-karotenu [6]. Superkritický oxid uhličitý je též studován jako prostředí pro homogenně katalyzované reakce, např. oxidaci celulózy [7], hydrogenaci styrenu [8] a lipázou katalyzovanou syntézu poly-L-laktidu [9].
Oxid uhličitý se běžně používá v nápojovém průmyslu nejen při výrobě sycených nápojů, ale často také jako ochranná atmosféra při jejich přepravě a uchovávání v provoze i při stáčení. Eliminuje se tak škodlivé působení kyslíku, který nepříznivě ovlivňuje senzorickou stabilitu a trvanlivost výrobku.
Oxid uhličitý se využívá i při čištění textilií. Protože textilie nejsou v kontaktu s organickým rozpouštědlem, může se jejich životnost prodloužit o 30–40 %. Některé evropské hotely již nabízejí jako službu hostům čištění prádla v takových čistírnách.
Impregnace dřeva superkritickým oxidem uhličitým nahrazuje vodné impregnační roztoky i systémy s organickými rozpouštědly. Odpadá sušení a výhodou je i velká penetrační schopnost.
Oxid uhličitý je používán též jako hnací plyn ve sprejích. Nahrazuje chlorofluorované uhlovodíky, které poškozují ozonovou vrstvu.
V neposlední řadě nachází oxid uhličitý uplatnění v hasicích přístrojích. Jeho účinek je kombinovaný. Jednak ve formě sněhu (suchého ledu) ochlazuje plamen, jednak vzhledem k tomu, že je těžší než vzduch, vytváří nad hořícím předmětem ochrannou atmosféru, která zabraňuje přístupu kyslíku. Oxid uhličitý je nevodivý, lze jím tedy hasit i elektrická zařízení pod proudem. Při hašení nevznikají další škodlivé látky a nezůstávají rezidua jako při používání hasicích přístrojů pěnových či práškových. Lze jej tedy použít při hašení požárů ve skladech potravin nebo v archivech, neboť nedojde ke znehodnocení skladovaného materiálu a předmětů, jež nebyly požárem zasaženy.
Zajímavou aplikací je čištění znečištěných povrchů tryskáním peletami suchého ledu [10]. Pelety jsou na čištěný povrch unášeny proudem stlačeného vzduchu. Povrch je čištěn trojím účinkem: kinetickou energií pelet, ochlazením, jímž je vrstva nečistot narušena, a expanzí při sublimaci oxidu uhličitého. Odstraněné nečistoty lze pak zamést, není nutno likvidovat rezidua rozpouštědel.
Oxid uhličitý je využitelný i jako chladicí médium. Např. v potravinářství se s výhodou používá tzv. kryogenní šokové zmrazování kapalným oxidem uhličitým, které je velmi šetrné a dobře zachovává vzhled i chuť potravin po rozmrazení [11].
Tepelná čerpadla s pracovní látkou oxidem uhličitým se v praxi osvědčila nejčastěji k přípravě teplé vody při využití odpadního tepla, vhodné nasazení se nabízí u průmyslových sušicích procesů apod. [12]. Zajímavé je technické řešení, které je kombinací tepelné CO2-trubice jako hloubkové zemní sondy zkombinované s tepelným čerpadlem. Tepelná trubice fungující jako výměník, kde probíhá stálá cirkulace oxidu uhličitého na základě samovolného odpařování a kondenzace, převádí z podzemí teplo na povrch bez potřeby oběhového čerpadla. Na povrchu takto přivedené teplo využívá tepelné čerpadlo s proměnlivou frekvencí otáček kompresoru. Tato zařízení dosahují nadprůměrných topných faktorů a s tím spojené významné úspory energie [13].
Currently carbon dioxide is commonly referred to as a difficult waste, which must be disposed in some way. The methods of disposal are often questionable (eg CCS) associated with high costs and uncertain effect. A rational approach in line with modern trends, however, is trying to use it as raw material. Overview of the technical possibilities of carbon dioxide utilization is presented.